2023-03-10
2023年3月10日,据中国国家药品监督管理局(NMPA)药品审评中心(CDE)公开信息显示,惠和生物申报的I类创新药CC312冻干粉针剂获批得NMPA临床试验许可(受理号:CXSL2200621),适应症为复发/难治性CD19阳性B细胞恶性血液肿瘤。CC312是惠和生物自主研发的TriTETM平台首个产品,也是国内第一款、全球第三款获批临床的基于CD28共刺激信号的三特异性抗体。这是继CC312于2022年5月14日获得FDA临床默示许可后的又一里程碑进展,标志着该产品在中美两地进入临床研究阶段。
图片来源:CDE官网
关于CC312
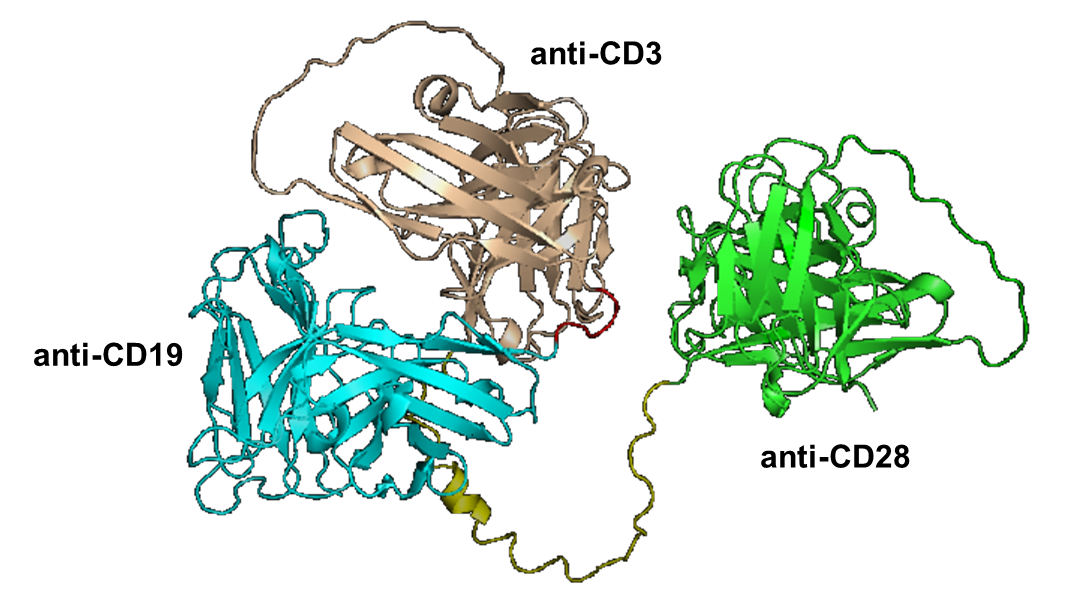
Amgen公司的博纳吐单抗Blinatumomab(商品名Blincyto®)靶向CD3xCD19,不仅价格昂贵,而且连续静脉输注4周的给药模式十分不便,CC312(CD19xCD3xCD28)在针对血液瘤的临床前研究中表现出良好的药理学特性、生物利用度、安全性以及有效性和较长的半衰期,是CD19xCD3双抗的升级版,具有临床替代性。CC312作为抗体药版的CAR-T,在患者依从性和可及性方面具备独特的优势,兼具CAR-T、单抗、双抗的优势,具有取代CAR-T疗法的巨大潜力。

惠和生物创始人、董事长 朱化星博士表示
“CC312项目获得NMPA临床试验研究许可,这对惠和生物来说是一个重大的里程碑事件,作为中国首个获得中美IND许可的基于双信号活化机制的三抗药物,打破了国外新药开发的垄断地位,我们感到非常骄傲,我们将全力推进CC312的I期临床研究,尽早地让更多的受试者获益。惠和也将继续秉承“持续创新,惠济于民,和衷共济,海纳百川”的理念,为临床和病患提供更多、更好、更可负担的新药。”
法律声明沪ICP备2022004270号 沪公网安备31011502401491号
COPYRIGHT@CytoCares 2022.
DIGITAL By VTHINK
